كم عدد الاكترونات التي تحتاجها الذرة بشكل عام في مستواها الخارجي لتكون أكثر استقراراً
كم عدد الاكترونات التي تحتاجها الذرة بشكل عام في مستواها الخارجي لتكون أكثر استقراراً، من الأسئلة التي يتم سؤاله مؤخرًا بين الطلاب والطالبات في المملكة والسبب في ذلك أن مناهجهم تشمل هذه المسألة خاصة في الكيمياء.
العلم بشكل عام من أهم الأشياء التي يمكن أن يدرسها الإنسان في حياته لأنه قادر على تفتيح الأفق وتوسيع رؤية الإنسان بشكل عام، وهذه الأشياء التي يكتشفها العلماء في علم الكيمياء هي الذرة التي هي أصغر وحدة فعلية لمادة ما على سطح الأرض بينما يمكننا إخبارك بالإجابة الصحيحة لسؤالك من خلال أحد أهم المواقع الموجودة حاليًا وهو الموقع بالإضافة إلى توضيح ما هي مستويات الطاقة المدارية الرئيسية في الذرة تابعنا من خلال التعرف في الأسطر القليلة التالية من مقالتنا على كيفية توزيع الإلكترونات في المناطق دون المدارية.
كم عدد الاكترونات التي تحتاجها الذرة بشكل عام في مستواها الخارجي لتكون أكثر استقراراً
تعرف الذرة على أنها أصغر وحدة يمكن استخلاصها من مادة من حولنا عندما تكون تلك المادة مجزأة، والذرة عبارة عن جسم صغير بشحنة متعادلة، ولكن في حالة تفتيت الذرة نفسها، فإن هذه الأجزاء ستحمل ما يسمى بالشحنة الكهربائية، وتجدر الإشارة إلى أن الذرة هي عمومًا الدعامة الأساسية للكيمياء، بالإضافة إلى أصغر وحدة من المواد التي تحتوي على خواص كيميائية، وفي الذرة توجد مجموعة من الإلكترونات في مركز مستويها ومداراتها المتعددة سوف نشرح الإجابة الصحيحة على سؤالك والتي جاءت كالتالي
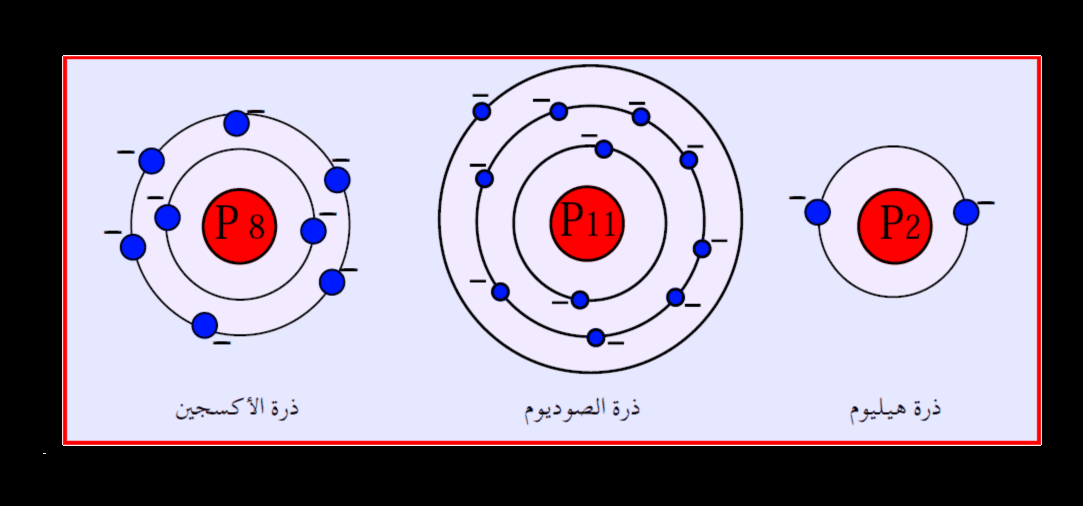
- الجواب هو عدد الإلكترونات التي تحتاجها الذرة في مستواها الخارجي بشكل عام لتصبح أكثر استقرارًا هو 8.
- والإلكترونات في الذرة هي سلسلة من الجسيمات دون الذرية التي لها شحنة سالبة.
- ثم تنتمي الإلكترونات أيضًا إلى الجسيمات الأولية في الذرة.
- وتجدر الإشارة إلى أن للإلكترونات الموجودة في الذرة العديد من الخصائص، بينما نشرح لكم بعض هذه الخصائص من خلال الأسطر التالية
- ولا تحتوي الإلكترونات على مكونات بالداخل ولا يمكن تجزئتها.
- ثم الإلكترونات هي أقل الأجسام ثقلاً بين مكونات الذرة، حيث تبلغ كتلة الإلكترون حوالي 9.10938356 × 10-31 كيلوجرامًا، وتجدر الإشارة إلى أن هذه الكتلة لا تُحسب أبدًا من حساب الكتلة الذرية نظرًا لصغر حجمها.
- توجد الإلكترونات حول نواة الذرة.
- ولكنها موزعة بطريقة منظمة على مستويات طاقة الذرة.
- ثم تجدر الإشارة إلى أنه عند إزالة الإلكترون من مستواه حول نواة الذرة، تتأين الذرة، أي تصبح أيونًا.
- بالإضافة إلى إمكانية تعايش الإلكترونات مع الأيونات في حالة فيزيائية تسمى البلازما.
- وبالنظر إلى أنه وفقًا لتصنيف علماء الجسيمات الأولية، توجد الإلكترونات في مجموعة من الفرميونات وتم تسميتها بهذا الاسم بسبب مكتشفها فيرمي ديراك، الذي لم يكن فقط مبتكر طريقة فيرمي الإحصائية
من هو مكتشف الإلكترونات
سبق أن أوضحنا أن الإلكترونات هي أحد مكونات الذرة لأن هذه الإلكترونات تتحرك حول النواة في العديد من المدارات، وتتنقل من مستوى إلى آخر حتى تصبح الذرة مستقرة، ولكن السؤال الذي يطرح نفسه، من كان أول من اكتشف الإلكترونات، كما نشرح لكم المكتشف الحقيقي الأول يتعلق بالنقاط التالية
- أول من اكتشف الإلكترونات كان العالم الشهير طومسون جونيور، واسمه الكامل جوزيف جون طومسون.
- وحيث اكتشف طومسون الإلكترون أثناء دراسته لأشعة الكاثود.
- ثم كانت تلك الفترة في نهاية القرن التاسع عشر، وكان رأي العلماء في ذلك الوقت أن الذرة تتكون من أكثر من وحدة رئيسية واحدة، وليست واحدة.
- لقد بدأت بالفعل تجارب أشعة الكاثود جاء جوزيف جون طومسون طومسون إلى هنا ليرى أن أشعة الكاثود يمكن ثنيها بسهولة بواسطة المجال الكهربائي والمجال المغناطيسي، ومن هنا اكتشف طومسون الإلكترون.
- وتجدر الإشارة أيضًا إلى أن هذا الاكتشاف قد قطع شوطًا طويلاً نحو تحديد بنية الذرة بشكل أكثر وضوحًا، حيث أن النواة عبارة عن جسم موجب الشحنة تدور حوله سلسلة من الإلكترونات سالبة الشحنة، مما يخلق قوة كهربائية بين نواة التوصيل و تجتذب الإلكترونات نحو النواة المركزية.
مستويات الطاقة في الذرة
الآن بعد أن أوضحنا لك في الفقرات السابقة من هو أول عالم اكتشف الإلكترون، بالإضافة إلى إدراك أن المستوى الأخير مشبع بثمانية إلكترونات، نحتاج إلى الدخول في المناقشة لفهم مفهوم مستويات الطاقة و لتحديد المدارات التي تدور فيها الإلكترونات حول النواة، هذا هو السبب في أننا نشرح لك مستويات الطاقة والتي تأتي على النحو التالي
- مستويات الطاقة هي المسافة المحددة بين النواة في الذرة والموضع المتوقع للإلكترونات السالبة حول النواة.
- وتدور الإلكترونات السالبة حول النواة الموجبة.
- ثم من الجدير بالذكر أن هذه المدارات تقع ضمن ما يعرف بمستويات الطاقة الفرعية.
- يتم توزيع هذه المستويات الفرعية، والتي تقع بدورها ضمن مستويات الطاقة الرئيسية، ضمن المستويات الرئيسية وفقًا لقدرة كل مستوى على قبول أكبر عدد من الإلكترونات السالبة.
- وتحتوي الذرة على سبعة مستويات للطاقة، وتتم الإشارة إلى مستويات الطاقة الرئيسية بالرموز التالية
- ثم المستوى الأول ك.
- والمستوى الثاني L.
- ثم المستوى الثالث M.
- المستوى الرابع N.
- والمستوى الخامس O.
- ثم المستوى السادس P.
- المستوى السابع س.
- ويتركز تدفق الإلكترون في المستويات الأربعة الأولى، مستويات الطاقة الرئيسية في الذرة (K / L / M / N).
- ثم بينما تحتوي مستويات الطاقة الرئيسية الأربعة أيضًا على مدارات فرعية، يتم الإشارة إلى هذه المدارات بالرموز
- س.
- ص.
- د.
- F.
طريقة توزيع الإلكترونات في المدارات
ثم علمنا ما هي مستويات الطاقة، بغض النظر عما إذا كانت طاقات كبيرة أو ثانوية، وتعلمنا أن الإلكترونات تدور في مدارات مختلفة ضمن هذه المستويات، وكيفية توزيع هذه الإلكترونات على مستويات طاقة مختلفة عن طريق شرح مبسط نصه كالتالي
- مستوى الطاقة الأول (K) هو أدنى مستوى طاقة للذرة.
- وحيث تنتقل الإلكترونات إلى المستوى الثاني ثم إلى المستويين الثالث والرابع حتى تصبح الذرة أكثر استقرارًا.
- ثم تجدر الإشارة أيضًا إلى أن الإلكترونات يمكن أن تنتقل من مستوى إلى آخر، ولكن في هذه الحالة يجب أن تكون الذرة في حالة امتصاص أو إطلاق للطاقة.
- وأي، من الناحية العلمية، يجب إما أن يكتسب الطاقة بحيث ينتقل الإلكترون من مستوى أدنى إلى مستوى أعلى بعد التشبع، أو يفقد الطاقة لإعادة الإلكترون إلى مستوى الطاقة الأدنى.