بحث عن التوزيع الإلكتروني doc
بحث عن التوزيع الإلكتروني doc، الذرة هي أصغر جسيم في المادة وهي اللبنة الأساسية لكل عنصر في الجدول الدوري، والذرة، بطبيعتها متناهية الصغر، تتكون من مجموعات مختلفة من البروتونات موجبة الشحنة، الإلكترونات سالبة الشحنة، والنيوترونات ذات الشحنة المحايدة، ومن خلالها سنقوم بتضمين بحث متكامل عن التوزيع الإلكتروني لعناصر الجدول الدوري.
مقدمة بحث عن التوزيع الإلكتروني
ثم تتكون كل مادة في الطبيعة من ذرات وتتكون الذرة من ثلاثة أجزاء رئيسية هي البروتونات والنيوترونات والإلكترونات لأن البروتونات تحمل شحنة موجبة والنيوترونات لها شحنة متعادلة وتشكل كل من البروتونات والنيوترونات معًا نواة الذرة، بينما تحيط بالنواة إلكترونات، وهي جسيمات ذات شحنة لها مدارات سالبة حول نواة الذرة التي تدور فيها، وشحنتها السالبة تساوي الشحنة الموجبة للبروتونات، مما يجعل الذرة كهربائية محايد في حالة مستقرة.
بحث عن التوزيع الإلكتروني
ولفهم ذرة العنصر، من الضروري فهم آلية التوزيع الإلكتروني لكل من المكونات الثلاثة للبروتونات والنيوترونات والإلكترونات التي تدور في مدارات ثابتة ومستقرة، وسيكون هذا تسلسلاً بالطريقة التالية
ما هو تعريف الذرة
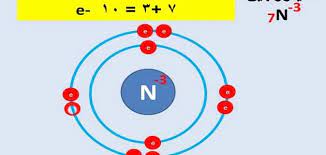
ثم إن الذرة هي أصغر وحدة من كل عنصر وهي أساس البناء والتكوين، وتتكون من نواة من البروتونات موجبة الشحنة والنيوترونات معتدلة الشحنة والإلكترونات سالبة الشحنة، وكلها تدور حول النواة وإذا كانت تحتوي على إلكترونات، وكان حجم الذرة النموذجية حوالي 0.1 نانومتر، ومعظم حجمها عبارة عن مساحة فارغة، وهي موقع الإلكترونات، وعادة ما تكون الذرات الصغيرة متشابهة في الشكل، لذا فهي كروية الشكل.
عدد الإلكترونات في المدار
ويتكون كل عنصر من عناصر الجدول الدوري في أساسه الإلكتروني من ذرة تتكون من البروتونات والنيوترونات والإلكترونات، وتتميز الإلكترونات بأنها ذات شحنة سالبة تقع حول النواة في المدارات، بحيث يتم تحديد هذه المدارات بحجم الفجوة التي يمكن أن توجد فيها الإلكترونات بمعدل محتمل 95 ٪، والمدار في المدارات الأربعة المختلفة (s، p، f، d) يستوعب إلكترونين، والمستويات الثانوية في المدارات (p، f، d)، باستثناء المدار s، يمكن أن يحمل عددًا أكبر من الإلكترونات، بالإضافة إلى الاختلاف في عدد الإلكترونات الحد الأقصى الذي يمكن أن تدعمه الأصداف الداخلية لأنواع مختلفة من المدارات.
نمط توزيع الإلكترونات في المدارات
ثم هناك نمط محدد لترتيب الإلكترونات في المدارات (1s، 2s، 2p، 3s، 3p، 4s، 3d، 4p، 5p، 6s، 4f، 5d، 6p، 7s، 5f) وكل من هذه المدارات يمكن أن تحمل إلكترونان فقط أي أنه يمكن أن يحمل إلكترونًا واحدًا فقط s، p، d المداري ولكن هناك المزيد من المدارات في f، d مقارنة بالمدارات p، s وبالتالي يمكن لكل نوع من هذه المدارات الداخلية أن يحمل عددًا معينًا من الإلكترونات على النحو التالي المدار يحتوي المدار s على إلكترونين فقط، بينما يحتوي المدار p على ستة إلكترونات، ويحتوي المدار d على عشرة إلكترونات، ويحتوي المدار f على أربعة عشر إلكترونًا.
قواعد التوزيع الإلكتروني للعناصر
ثم يعبر التوزيع الإلكتروني للعنصر عن كيفية ترتيب الإلكترونات في مستويات الطاقة حول نواة العنصر وكيف يمكن معرفة كيفية توزيع الإلكترونات في مداراتها من خلال ما يلي
ترتيب المدارات
ويتم ترتيب المدارات حول نواة ذرة عنصر على النحو التالي
- المدار k هو أول مدار مداري أقرب إلى النواة.
- والمداري L يعبر عن المدار الثاني.
- ثم المداري M يعبر عن المدار الثالث.
- المداري N يعبر عن المدار الرابع وأكبر مسافة من نواة العنصر.
التوزيع الإلكتروني
ثم تتوزع الإلكترونات في مدارات نشطة حول النواة بشكل ثابت، بدءًا من إلكترون واحد، ثم ثمانية إلكترونات، ثم ستة عشر إلكترونًا، وتنتهي باثنين وثلاثين إلكترونًا، بحيث يتم ترتيبها من مدار K الأول، مرورًا بالثانية يدور في مدار L، ثم M الثالث ثم N، لذلك لا يمكن الانتقال إلى المدار الثاني ما لم يكن المدار الأول ممتلئًا بالإلكترونات، وتجدر الإشارة إلى أنه ليست كل المدارات ممتلئة بالضرورة بالإلكترونات، وهذا يختلف باختلاف المدار لأن العناصر المختلفة لها أعداد مختلفة من الإلكترونات.
سعة المدارات
وتعبر سعة المدار النشط حول نواة ذرة العنصر عن احتمال أن يحتوي المدار على عدد معين من الإلكترونات، لأن أكبر عدد من الإلكترونات الموجودة في المدار هو ناتج 2n2، حيث يمثل n المدار عدد، ومن هذا يمكن أن تعرف أعلى سعة ممكنة لكل مدار على النحو التالي
- أكبر سعة للمدار الأول هي إلكترونين فقط وفقًا للمعادلة 2 (1) 2
- وأكبر سعة للمدار الثاني هي ثمانية إلكترونات فقط وفقًا للمعادلة 2 (2) 2
- ثم أكبر سعة للمدار الثالث هي ثمانية عشر إلكترونًا وفقًا للمعادلة 2 (3) 2
- أكبر سعة للمدار الرابع هي 32 إلكترونًا وفقًا للمعادلة 2 (4) 2
مستويات الطاقة
ثم تختلف مستويات الطاقة بين كل مدار بالترتيب مع بدء الزيادة والانتقال إلى مدار أعلى يحمل المدار الأول أدنى مستوى للطاقة ويحمل المدار الأخير معظم مستوى الطاقة، مما يعني أن النمو يبدأ من الأول إلى الأعلى، وتتوزع مستويات الطاقة على النحو التالي
- k المداري أول وأدنى مستوى للطاقة.
- والمداري L مستوى الطاقة الثاني.
- ثم مدار M مستوى الطاقة الثالث.
- المداري N رابع وأعلى مستوى للطاقة.
المدارية الفرعية حول النواة
وهناك أربعة مدارات رئيسية حول نواة ذرة العنصر، والتي يتم توزيعها في مدارات ذات طاقة متفاوتة، ولكل مدار رئيسي مجموعة من المدارات الفرعية التي تختلف في العدد حسب مرؤوسيهم، لذلك يتم توزيعها على النحو التالي
- k المداري يحتوي على مدار فرعي 1s.
- والمداري L يحتوي على المدارات 2s و 2p.
- ثم مداري M يحتوي على ثلاثة مدارات وهي 3s و 3 p و 3 d.
- ومداري N له أربعة مدارات وهي 4s و 4 p و 4 d و 4 f.
السعة الإلكترونية للمدارات الفرعية
ويحدد القانون السعة الإلكترونية لأي شبه مداري ينتمي إلى المدار الرئيسي حول نواة ذرة العنصر 2 × (2l + 1)، على النحو التالي
- K مداري له مداري، حيث i = 0، (2 * 0 +1) في 1 ثانية.
- وL المداري له جزئين شبه مداريين، i يساوي صفرًا في 2s ويساوي 1 في 2p.
- ثم مداري M له ثلاثة مدارات فرعية، أنا صفر في 3 ثوانٍ، واحد في 3 بكسل واثنان في صورة ثلاثية الأبعاد.
- N مداري يحتوي على أربعة مدارات فرعية، i يساوي صفرًا في 4 ثوانٍ، وواحد في 4d، واثنان في 4p وثلاثة في 4f.
أكبر عدد يمكن أن تستوعبه المدارات الفرعية
ثم يمكن حساب أكبر عدد من المدارات الفرعية الإلكترونية بواسطة قانون 2 × (2l + 1)، أي باستبدال قيمة I في المعادلة على النحو التالي
- عدد الإلكترونات في المدار s هو 2 x (2l + 1) = 2 x (2 (0) + 1) = 2 إلكترون.
- وعدد الإلكترونات في المدار p هو 2 x (2l + 1) = 2 x (2 (1) + 1) = ستة إلكترونات.
- ثم عدد الإلكترونات في المدار d هو 2 x (2l + 1) = 2 x (2 (2) + 1) = عشرة إلكترونات.
- عدد الإلكترونات في المدار f هو 2 x (2l + 1) = 2 x (2 (3) + 1) = أربعة عشر إلكترونًا.
نماذج وأمثلة على التوزيع الإلكتروني
ثم فيما يلي مجموعة من الأمثلة التوضيحية لتوزيع الإلكترون لذرات العناصر المختلفة
- المثال الأول اكتب تكوين الإلكترون لذرة الأكسجين، O، التي يبلغ عددها الذري 8 الحل يوجد إلكترونان في المدار الأول وستة إلكترونات في المدار الأخير.
- ومثال 2 اكتب تكوين الإلكترون لذرة الصوديوم، Na، وعددها الذري 11 الحل يوجد إلكترونان في المدار الأول، وثمانية إلكترونات في المدار الثاني، وإلكترون واحد في المدار الأخير.
- ثم مثال 3 اكتب ذرة الإلكترون في ذرة الكالسيوم، Ca، العدد الذري هو 20 الحل في المدار الأول يوجد إلكترونان، في المدار الثاني ثمانية، في المدار الثالث هناك ثمانية، والأخير المدار إلكترون.
خاتمة بحث عن التوزيع الإلكتروني
والذرة هي أصغر عنصر في المادة، وتتكون من بروتونات موجبة الشحنة، ونيوترونات محايدة الشحنة، وإلكترونات سالبة الشحنة، وتدور الإلكترونات في مدارات ثابتة حول النواة، لكنها تختلف في مستويات طاقتها، وكل مدار يضم عددًا معينًا فقط من الإلكترونات التوزيع الإلكتروني لأي ذرة من عنصر باتباع ثلاث قواعد أساسية، وهي السعات المدارية، ومستويات الطاقة، والمدارات الفرعية لكل مدار رئيسي في النواة الذرية.
بحث عن التوزيع الإلكتروني doc
وعندما ندرس التوزيع الإلكتروني للعنصر، من الضروري أولاً فهم طبيعة الذرة ومكوناتها من البروتونات والنيوترونات والإلكترونات، ثم كيفية توزيع الإلكترونات في مدارات حول الذرة، بحيث تبدأ بالوجود من إلكترونين في المدار الأول، ثم ثمانية إلكترونات في المدار الثاني، ثم ثمانية عشر إلكترونًا في المدار الثالث، تنتهي باثنين وثلاثين إلكترونًا في المدار الأخير، ويمكن فهم توزيع الإلكترون بطريقة بسيطة عن طريق البحث لقد ضمنت بتنسيق “doc”.
بحث عن التوزيع الإلكتروني pdf
ثم في البحث عن توزيع الإلكترونات، قمت بتضمين بداية تعريف الذرة، ثم عدد الإلكترونات في المدار، والانتقال إلى نموذج توزيع الإلكترونات في المدارات، والانتقال إلى قواعد توزيع الإلكترونات للعناصر ، ثم المدارات الفرعية حول النواة، وتنتهي بمجموعة من الأمثلة التوضيحية لكيفية توزيع الإلكترون، ويمكنك تنزيل بحث عن التوزيع الإلكتروني بتنسيق pdf “”.