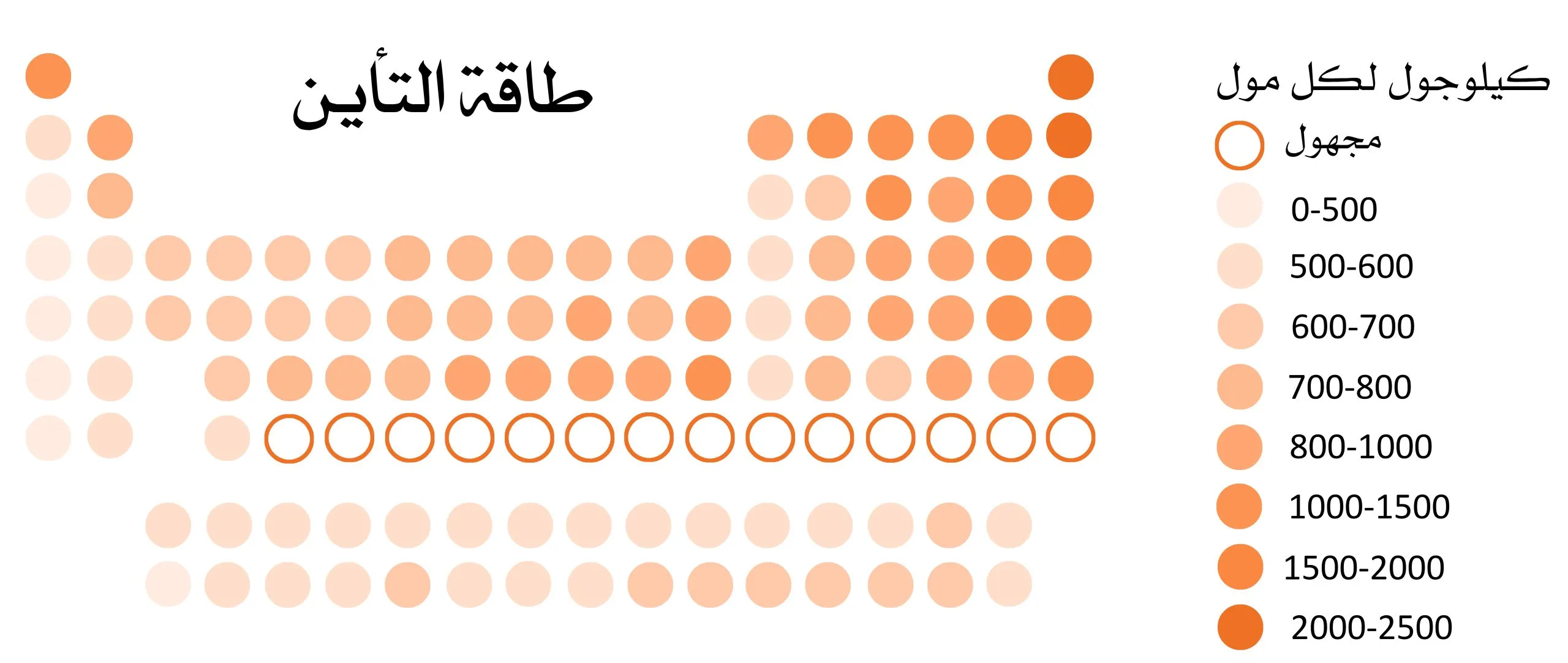
تزداد طاقة التاين في الجدول الدوري لكل دورة كلما اتجهنا من
تزداد طاقة التاين في الجدول الدوري لكل دورة كلما اتجهنا من، يعد الجدول الدوري من اهم الاسهامات للعالم مندليف في مادة الكيمياء العلمية، وطاقة التاين في الجدول الدوري تزداد وتنخفض، أحد الأسئلة المعروفة في الكيمياء، وأهمية بحث الطلاب عن إجابة قصيرة لهذا السؤال واضحة، حيث أنه أحد الموضوعات يتم تغطيتها في برامج التدريس، مع التركيز على إطلاع الطالب على المقصود بتأين الطاقة في دراسة الكيمياء، ومن هنا سيمنحك الفرصة لمعرفة الإجابة على سؤال مهم للغاية تم طرحه، في بالإضافة إلى بعض الموضوعات ذات الصلة.
ما أهمية علم الكيمياء
إنه العلم الذي لعب دورًا مهمًا في دراسة مكونات المادة والتغيرات التي حدثت فيها، والتي تشارك في العديد من المجالات ولها جانب مهم في الصناعات على اختلاف أنواعها، تتطلب المعرفة الدقيقة بالكيمياء المعرفة من المجالات العلمية الأخرى وهذا هو السبب في أن دراسة الكيمياء إلزامية في الخطط الدراسية، والوزارة في جميع المراحل، والعديد من التخصصات الجامعية توصي بمعرفة جيدة بالكيمياء وعلومها، والأهم من ذلك، لا تمنعنا، أن نقول إن الكيمياء مثيرة للاهتمام للغاية في تفاعلاتها، في انتظار نتائجها والمختبرات التي تعمل فيها.
تزداد طاقة التاين في الجدول الدوري لكل دورة كلما اتجهنا من
نقدم الإجابة الصحيحة والأفضل على السؤال الذي ورد في كتاب الكيمياء لهذا الفصل الدراسي والذي يقول “هل تزداد طاقة التأين في الجدول الدوري لكل دورة ننطلق منها”، والإجابة هي
- من اليسار الى اليمين.
كلما زادت طاقة التأين في الجدول الدوري لكل دورة كلما ننتقل من اليسار إلى اليمين، لأن ترتيب العناصر في الجدول الدوري يتبع العدد الذري وليس العدد الكتلي، والذي يتضمن عدد البروتونات والنيوترونات الموجودة في النواة و وهكذا تم توضيح الإجابة النهائية للجملة السابقة.
أهم خصائص الجدول الدوري
ومن أبرز سمات الجدول الدوري نلخصه في الآتي، حيث أن الجدول الدوري يحتوي على عناصره الكيميائية مرتبة في صفوف وأعمدة كما هو موضح في الصورة أعلاه ومن بين معالمه
- يحتوي على 118 عنصرًا كيميائيًا.
- معظم العناصر هي المعادن القلوية والأرضية والانتقالية والقاعدة.
- يحتوي على سبع دورات أفقية.
- يحتوي على 18 عمودًا رأسيًا (مجموعة).
- يرتب الجدول الدوري عناصره حسب العدد الذري المتزايد.
- عناصر نفس المجموعة لها نفس الخصائص ولها نفس الترتيب في المدار الأخير.
- تميل العناصر في المجموعات الأولى والثانية والثالثة إلى فقدان الإلكترونات.
- تميل العناصر في المجموعات IV و V و VI إلى اكتساب الإلكترونات.
- تنتهي كل فترة في الجدول الدوري بعنصر خامل (نبيل)، يكون مداره الأخير ممتلئًا.
- تحدد الإلكترونات المدارية الأخيرة للعنصر، أو إلكترونات التكافؤ، رقم الفترة التي ينتمي إليها العنصر.
- يوجد أسفل الجدول الدوري سلسلتان طويلتان من العناصر تسمى اللانثانيدات والأكتينيدات، تحتوي كل منها على 14 عنصرًا.
- تُصنف عناصر الجدول الدوري إلى معادن وغير فلزات وأشباه فلزات بينهما.