ما رقم المجموعه التي لعانصرها مجالات طاقه خارجيه مستقره
ما رقم المجموعه التي لعانصرها مجالات طاقه خارجيه مستقره، يحتوي الجدول الدوري للكيمياء على العديد من العناصر التي تم اكتشافها من قبل العلماء ولكل عنصر خصائص محددة وأرقام ذرية وكتلية تختلف عن العناصر الأخرى لأنه يحتوي على مجال إلكتروني محدد ويحتوي الجدول الدوري على دورات ومجموعات تحتوي على عناصر كيميائية محددة، العديد من الأسئلة حول المجموعة التي تضم عناصر ذات مستوى طاقة خارجي مستقر، سنجيب عليها من خلال صفحة في السطور التالية، ما رقم المجموعه التي لعانصرها مجالات طاقه خارجيه مستقره.
ما رقم المجموعه التي لعانصرها مجالات طاقه خارجيه مستقره
تشترك عناصر المجموعة في الجدول الدوري في الخصائص الكيميائية المشتركة، والعناصر ذات مستوى الطاقة الخارجية المستقر تسمى العناصر “النبيلة” أو “الخاملة” وتختلف في خصائصها التفاعلية ؛ حيث تقل فعاليته، فإنه يحدث فقط في ظل ظروف قاسية وله العديد من الخصائص المميزة الأخرى.
- عند السؤال ما هو عدد المجموعة التي تمتلك عناصرها مجالات طاقة خارجية مستقرة الجواب هو المجموعة 18.
- تمتد الغازات النبيلة أو عناصر المجموعة الثامنة عشرة من الجدول الدوري إلى الفترة السادسة.
- تخلق التغييرات في المدارات والذرات في عناصر المجموعة نفسها تجاذبًا بين شحنات الإلكترونات وتحدد التغييرات بناءً على مستويات الطاقة.
- بالإضافة إلى عمله على تحسين الترابط بين جسمين، واللجوء إلى الكيمياء والفيزياء والتغييرات الجزئية حسب مستوى الطاقة.
- عناصر المجموعة الثامنة عشرة في الجدول الدوري هي
- الهليوم
- نيون
- الأرجون (عربي)
- كريبتون (كر)
- الرادون المشع (Rn)
- زينون (Xe)
- من المتوقع أن يتم تضمين Oganesson في المجموعة النبيلة، لكن هيكلها الكيميائي لم يتم فهمه بعد.
سبب تسمية الغازات النبيلة بهذا الاسم
الغازات النبيلة في الجدول الدوري للمجموعة 18 هي عناصر كيميائية لها خصائص مماثلة ؛ يشتهر بفقدان لونه ورائحته عند تعرضه لظروف قاسية، كما أنه أحادي الذرة وله تفاعل كيميائي منخفض، وعلى الرغم من ذلك، يتم استغلال القصور الذاتي في العديد من الأغراض، مثل الهيليوم المستخدم في أنابيب التنفس التي يستخدمها الغواصون ولن يتسمم بواسطة الغازات الأخرى.
- السؤال هو لماذا تسمى المجموعة 18 بالغازات النبيلة، وهناك عدة إجابات.
- نظرًا لأن خصائص هذه العناصر لا تتفاعل مع العناصر الأخرى، فهي تشبه خصائص النبلاء عند البشر.
- أو لأن هذه العناصر لا تحتاج إلى ذرات في مدارها الخارجي، حيث يصل عدد الذرات إلى ثمانية، وهو عدد كامل.
- قد يرجع سبب الاسم إلى كلمة “Edelgass” في اللغة الألمانية.
أمثلة على الغازات النبيلة
هناك العديد من الأغراض والصناعات التي يتم فيها استخدام أحد العناصر النبيلة، على الرغم من أنه غير نشط في التفاعل الكيميائي، إلا أن كل الأشياء من حولنا لها فائدة، ومن الأمثلة على استخدامه
- يتم نفخ البالونات الطائرة بغاز الهليوم وتمتلئ أنابيب التنفس الخاصة بالغواص بغاز الأكسجين ؛ حيث يصبح التنفس أسهل.
- يستخدم غاز الزينون في الصور المعروضة في مسارح IMAX حيث يملأ أضواء الإسقاط في الشاشات.
- تمتلئ أنابيب غاز النيون المضيئة بهذا العنصر، ويمكن تغيير لون الضوء من خلال طلاء الأنبوب، كما يستخدم في التخدير.
- يستخدم الجراحون مصابيح ليزر مليئة بالزينون والكريبتون والأرجون.
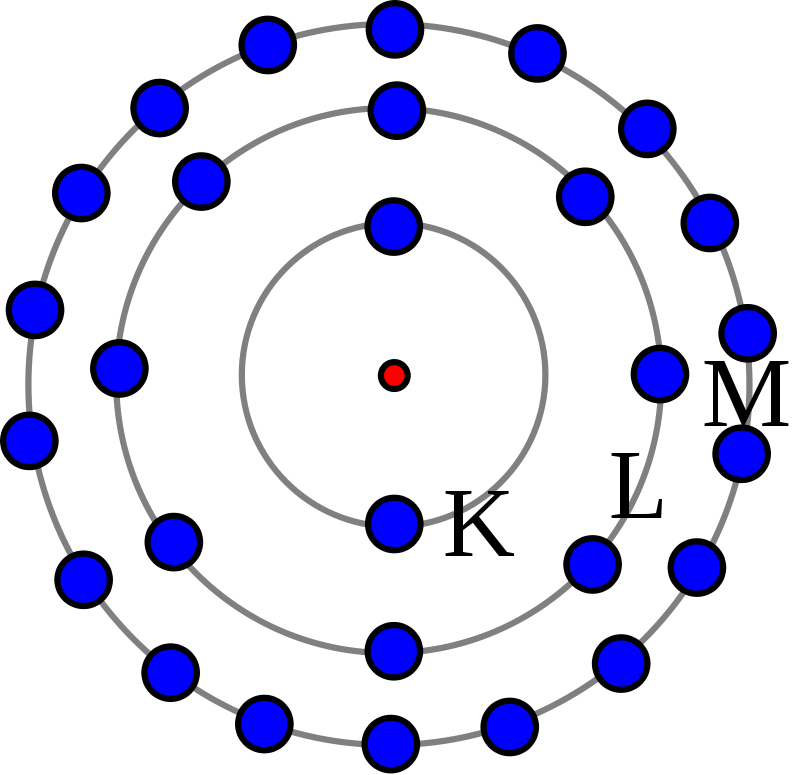
عدد مستويات الطاقة الرئيسة في النواة
تدور الإلكترونات في ذرات العنصر في مدارات معينة وفقًا لطاقتها، والأرقام عبارة عن أحرف تدل على مستوى الطاقة، مما يثير التساؤل عن عدد المستويات الرئيسية حول النواة الذرية.
- الأحرف المستخدمة لتعيين مستويات الطاقة الرئيسية هي K، L، M، N، O، P، Q، وتزداد الطاقة كلما زادت قيمة الرقم الكمي الرئيسي (n).
- تمتلئ الإلكترونات أولاً إلى أدنى مستوى للطاقة k ثم تأخذ ترتيبًا تصاعديًا بناءً على الثوابت لملء كل مستوى طاقة وقدرة المستوى على الاحتفاظ بها.
- يحتوي المستوى التالي على الرقم الكمي (n = 1) وهو مستوى الحرف K، ويحتوي المستوى الأبعد على الرقم الكمي (n = 7) وهو مستوى الحرف Q.
كيف تنتقل الإلكترونات بين مستويات الطاقة
فيما يتعلق بالإجابة على البيان العلمي المقدم، تتضمن الفيزياء الذرية قواعد الاختيار لميكانيكا الكم، والتي يتم تحديدها بعد انتقال الإلكترونات بين مستويات الطاقة في ذرات العناصر.
- تنتقل إلكترونات مستويات كل عنصر من المدار السفلي أو خط الطيف إلى المدار العلوي أو العكس.
- للقيام بذلك، يجب تعويض الاختلاف في طاقات نقل الإلكترون على كلا المستويين، على سبيل المثال عملية التسخين.
- نتيجة لانتقال الإلكترونات بين مستويات الطاقة، يتم إنشاء شعاع من الضوء يسمى “الفوتون”.
- عندما ينتقل الإلكترون من مستوى طاقة أعلى إلى مستوى أقل، فإن الشعاع الذي ينبعث منه يسمى طيف الانبعاث.
- العالم الذي حدد قواعد انتقال الإلكترونات في المستويات الذرية للعناصر هو الفيزيائي “إنريكو فيرمي”.
- اكتشف في الخمسينيات قوانين الذرة التي تسمح أو تمنع إلكتروناتها من الانتقال.
- تسمى عمليات نقل الإلكترونات بين مستوى الطاقة بالتحولات الإلكترونية وتتضمن عملية امتصاص أو إطلاق إلكترون.
ما اهمية الجدول الدروي
والجدول الدوري للعناصر له أهمية كبيرة في العلوم الكيميائية والفيزيائية هذا يحدد بسرعة ودقة رموز وخصائص العناصر، ويميز الأعداد الذرية، والخصائص المعدنية أو غير المعدنية، والفوائد الأخرى المستمدة من الجدول الدوري، ما رقم المجموعه التي لعانصرها مجالات طاقه خارجيه مستقره.
- في القرن التاسع عشر، طور العلماء مجال الكيمياء التحليلية من الجدول الدوري، والذي من خلاله صُنفت العناصر الكيميائية وفقًا للخصائص المهمة.
- تم الاتفاق أخيرًا على تصنيف الجدول الدوري من قبل الكيميائي الروسي دميتري مينديليف في عام 1869 م.
- ثم أضاف العالم جون ويليام مجموعة العناصر النبيلة في عام 1894 م، تلاه ويليام رامزي.
- الاختلاف في الطريقة التي رتب بها العلماء لتصنيف الجدول الدوري بين الماضي والحاضر هو أنه في الماضي كان مرتبًا بالوزن الذري ثم كان يعتمد على العدد الذري وتطوره.
- حتى الآن، تم استخدام الجدول الدوري من قبل الطلاب والمعلمين في مراحل مختلفة من الدراسة، مما يفسر أهميته الكبيرة.
- بالإضافة إلى ذلك، فإن مجموعات الجدول الدوري هي مجموعة للخصائص المشتركة للعناصر الكيميائية، ومن خلالها يمكن التنبؤ بالتفاعلات الناتجة عن اتحاد العناصر.
سمات وخصائص الجدول الدوري
يتميز الجدول الدوري بالعديد من السمات والقواعد الثابتة التي اتفق عليها العلماء في العديد من المجالات، على النحو التالي
- يتم تصنيف العناصر في الجدول الدوري من اليسار إلى اليمين ومن أعلى إلى أسفل بناءً على العدد الذري والعدد الكتلي.
- العناصر الموجودة في العمود الرأسي باسم “مجموعة”، ويُشار إلى العناصر الموجودة في الصف الأفقي باسم “دورة”.
- تتشابه عناصر مجموعة واحدة في التكوينات الإلكترونية، على سبيل المثال المجموعة الثامنة عشرة من العناصر الخاملة النبيلة.
- تصنف العناصر إلى ألوان مختلفة حسب خصائصها المعدنية ؛ بما في ذلك المعادن واللافلزات وشبه الفلزات.
- العناصر السائدة في الجدول الدوري هي العناصر المعدنية ؛ بما في ذلك المعادن القلوية والانتقالية والأساسية والأرضية.
- تتناقص الكهربية لعناصر الجدول الدوري كلما تحركنا من اليمين إلى اليسار وتزداد كلما تحركنا في الاتجاه المعاكس.
- العناصر في نفس المجموعة معًا لها نفس عدد الإلكترونات في آخر مستوى للطاقة، أو المدار، مما يشير إلى أنها تشترك في نفس الخصائص الكيميائية.