تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط
تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط، تتواجد في الزرات انواع مختلفة من العناصر مثل البروتونات والنيترونات والالكترونات التي لكل منها عددها المحدود وتكمن أهمية الجدول الدوري في تنظيمه لجميع العناصر الكيميائية الموجودة في الطبيعة، ويعتبر العالم الروسي ديمتري مندليف أول كيميائي ينشر نسخة من الجدول الدوري عام 1834 م وقام بتنظيم العناصر في أعمدة وصفوف ومجموعات، بحيث يكون لكل عمود أو مجموعة خصائص مشتركة معينة، وللاستفادة من المزيد من المعلومات، سنتعرف على الإلكترونات وكل ما يتعلق بها.
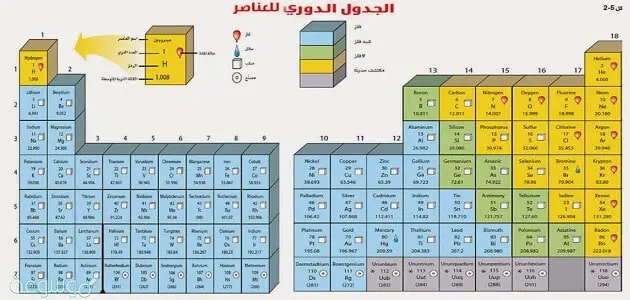
معلومات عن الجدول الدوري ويكيبيديا
يسمى الجدول الدوري باللغة الإنجليزية (الجدول الدوري) وهو عبارة عن ترتيب وتنظيم لجميع العناصر الكيميائية حسب عددها الذري وخصائصها الكيميائية، وعدد العناصر المعروفة هو 118، ومهمة الجدول الدوري هي تنسيق هذه العناصر في الأعمدة والصفوف وفقًا لأوزانها الذرية (أي الكتل المولية) وعندما تم ترتيبها بهذه الطريقة، ظهرت خصائص كيميائية متشابهة بين العناصر، ويمكن للجدول الذي أنشأه مندليف التنبؤ بالعناصر التي لم يتم العثور عليها أو اكتشافها في ذلك الوقت.
تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط
يشير مصطلح إلكترون التكافؤ، سواء في الفيزياء أو الكيمياء، إلى إلكترون مرتبط بذرة وموجود في الغلاف الخارجي، ويمكن لهذا الإلكترون المشاركة في إنشاء رابطة كيميائية (أي رابطة تساهمية) إذا لم يكن الغلاف الخارجي مغلقًا ونجد دائمًا أن العناصر الرئيسية هي إلكترونات التكافؤ الموضعية إنه موجود فقط على الغلاف الخارجي، ومن سياقه نستنتج أن العبارة تمثل فقط الإلكترونات النقطية في مجال الطاقة الخارجي
- العبارة الصحيحة
مجموعات الجدول الدوري
توجد المجموعات على شكل أعمدة رأسية مرتبة من 1 إلى 18، حيث يكون لكل العناصر في نفس المجموعة خصائص متشابهة، ويرجع ذلك إلى عدد الإلكترونات الموجودة على الغلاف الخارجي لكل ذرة (أي إلكترونات التكافؤ) وفي التالي سنقوم بإدراج العناصر الكيميائية في الجدول الدوري وفقًا لمجموعاتها
- المجموعة الأولى أو المجموعة 1A والتي تشمل كلا من المعادن القوية والهيدروجين، وتحتوي هذه المجموعة على إلكترون واحد فقط في غلافها الخارجي.
- المجموعة الثانية أو المجموعة 2A وتشمل معادن الأرض التفاعلية والتي تتميز بألوانها الجميلة عند الاشتعال، وتحتوي هذه المجموعة أيضًا على إلكترونين في الغلاف الخارجي.
- المجموعة الثالثة أو المجموعة 3 أ وتشمل المعادن بالإضافة إلى الطرفية حيث تعتبر شبه معدنية وتحتوي على 3 إلكترونات في الغلاف الخارجي.
- المجموعة الرابعة أو المجموعة 4 أ، وتشمل كلا من الفلزات وغير الفلزات وأشباه الفلزات، ويحتوي السيليكون والكربون على 4 إلكترونات في الغلاف الخارجي.
- المجموعة الخامسة أو المجموعة 5 أ وتشمل المعادن واللافلزات وشبه المعادن، كما يحتوي الفوسفور والنيتروجين على 5 إلكترونات في غلافها الخارجي.
- المجموعة السادسة أو المجموعة 6 أ وتشمل المعادن واللافلزات وشبه الفلزات
- تحتوي المعادن والكبريت والأكسجين على 6 إلكترونات تكافؤ.
- المجموعة السابعة أو المجموعة 7 أ، وتشمل اللافلزات شديدة التفاعل وجميع عناصرها تحتوي على 7 إلكترونات تكافؤ.
- المجموعة الثامنة أو المجموعة 8 أ، والمعروفة باسم مجموعة الغازات النبيلة، وتحتوي جميع عناصرها على غلاف خارجي إلكتروني بالكامل.