ما أكبر عدد من الإلكترونات يمكن أن يستوعبه مجال الطاقة الثالث في الذرة؟
ما أكبر عدد من الإلكترونات يمكن أن يستوعبه مجال الطاقة الثالث في الذرة؟، الذرة هي أصغر جزء من المادة يمكن دراسته، والذي يتكون في حد ذاته من أجسام دون ذرية، حيث تترابط الذرات لتشكل المواد التي نعرفها أو نراها في الطبيعة، والذرة محاطة بمجال طاقة يحدد مجالها من وفي مقالتنا اليوم من خلالكم نجيب على هذا السؤال ونتعرف أكثر على ما هو مجال الطاقة في الذرة وكل ما يتعلق به.
ما هي مجالات الطاقة في الذرة
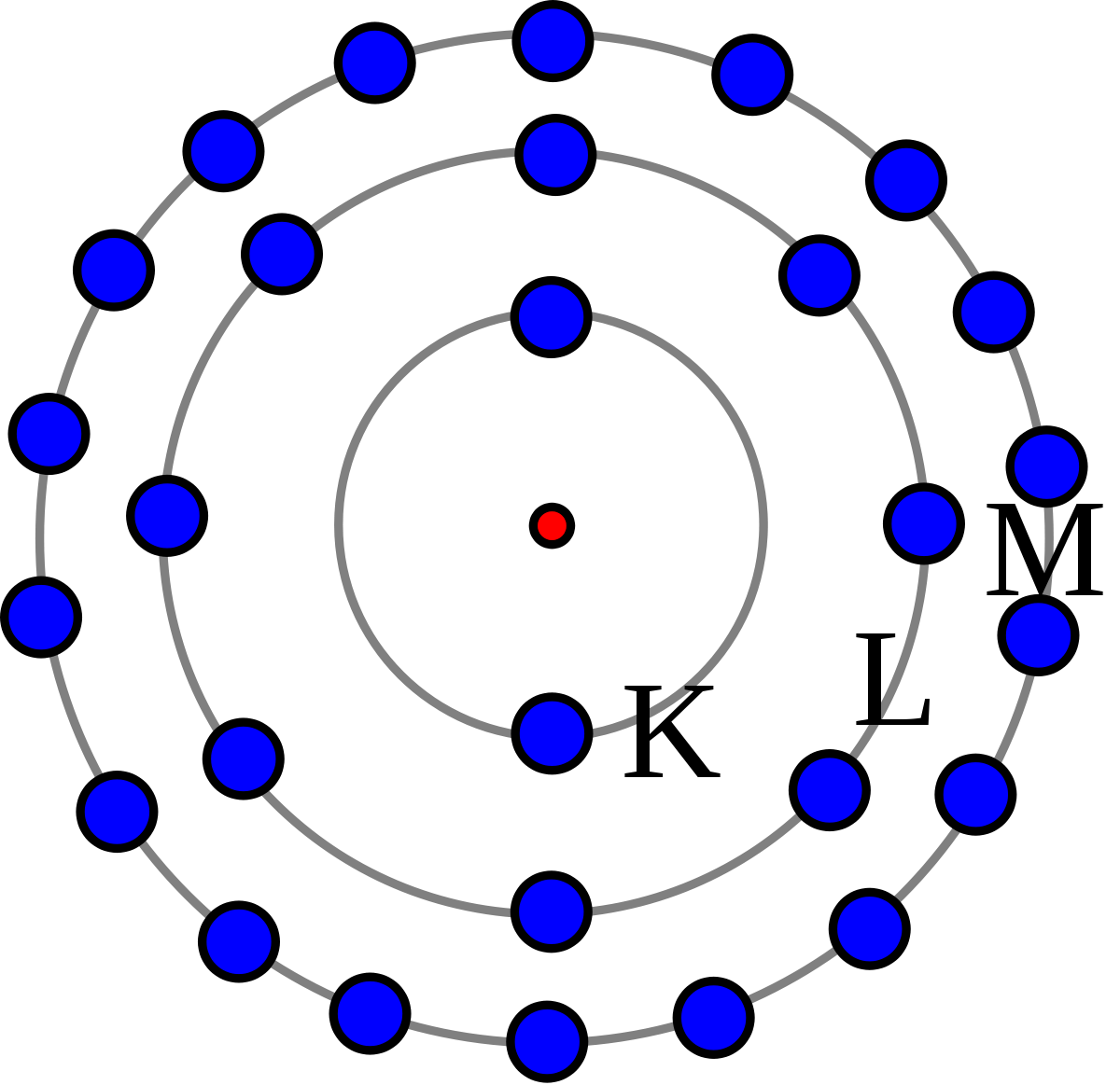
ثم في الفيزياء، تتكون الذرة من النواة والحقل المحيط بها النواة هي التركيب المركزي للذرة التي تقع في وسط الذرة تحتوي الذرة على بروتونات موجبة الشحنة ونيوترونات ليس لها شحنة ثابتة التي تتكون من إلكترونات سالبة الشحنة، وعلى الرغم من أن كل هذه الإلكترونات لها نفس الشحنة ونفس الكتلة الذرية، فإن لكل إلكترون في الذرة كمية مختلفة من الطاقة، وتختلف الطاقة التي تحملها الإلكترونات من مجال إلى آخر في بالقرب من الذرة، توجد الإلكترونات منخفضة الطاقة بالقرب من النواة، حيث تكون قوة الجذب للنواة موجبة الشحنة هي الأكبر، والإلكترونات ذات الطاقة الأعلى توجد في أماكن أبعد.
ما أكبر عدد من الإلكترونات يمكن أن يستوعبه مجال الطاقة الثالث في الذرة؟
ولقد رأينا سابقًا كيف يتشكل مجال الطاقة في الذرة، وبناءً على هذا المجال والعدد الذري، يتم تقسيم الحقل إلى عدة مستويات، والتي بدورها تحتوي على عدد معين من الإلكترونات التي تدور حول الذرة على سبيل المثال، في مجال الطاقة الثالث، يكون عدد الإلكترونات التي يحتوي عليها هو
- 18 إلكترونًا.
هذه الخاصية الفيزيائية للذرة، والتي شرحها لأول مرة الفيزيائي الدنماركي نيلز بور في عام 1913 م، هي نتيجة أخرى لميكانيكا الكم على وجه التحديد، والتي تنص على أن الزخم الزاوي لإلكترون يدور في المدار يأتي في حزم منفصلة تسمى الكوانتا، وهذا مجرد مثل أي شيء آخر في العالم
مستويات الطاقة الرئيسية
ثم مستويات الطاقة هي المناطق التي توجد فيها الإلكترونات حول الذرة حول النواة، والتي تشبه إلى حد كبير الفضاء ثلاثي الأبعاد المحيط بالنواة، ويمكن لكل مستوى طاقة أن يمتص أو يحتفظ بعدد مختلف من الإلكترونات قبل أن تبدأ الإلكترونات الإضافية بالمرور حتى المستوى التالي عندما يحتوي مستوى الطاقة الأول على إلكترونين، تنتقل الإلكترونات التالية إلى مستوى الطاقة الثاني حتى يحتوي المستوى الثاني على 8 إلكترونات ويصبح 10، عندما يحتوي مستوى الطاقة الثاني على 8 إلكترونات، تنتقل الإلكترونات التالية إلى مستوى الطاقة الثالث يحتوي على 8 إلكترونات، وعندما يحتوي مستوى الطاقة الثالث على 8 إلكترونات، ينتقل الإلكترونان التاليان إلى مستوى الطاقة الرابع وهكذا.