أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو
أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو، تحتوي كل ذرة من الذرات على الكترونات سالبة الشحنة، وبروتونات موجبة الشحنة، أحد موضوعات العلوم المقدمة في المنهج والتي تركز على إطلاع الطالب على المقصود بالطاقة الإلكترونية في الذرة والضوابط التي تحكم تلك الطاقة من حيث القوة. أو النقصان، وبناءً على هذه البيانات، ستمنحك فرصة للتعرف على الطاقة الإلكترونية في الذرة وآلية حساب مستويات هذه الطاقة وأقصى حجم لها في كل مستوى على حدة.
ما هو التوزيع الإلكتروني للعناصر
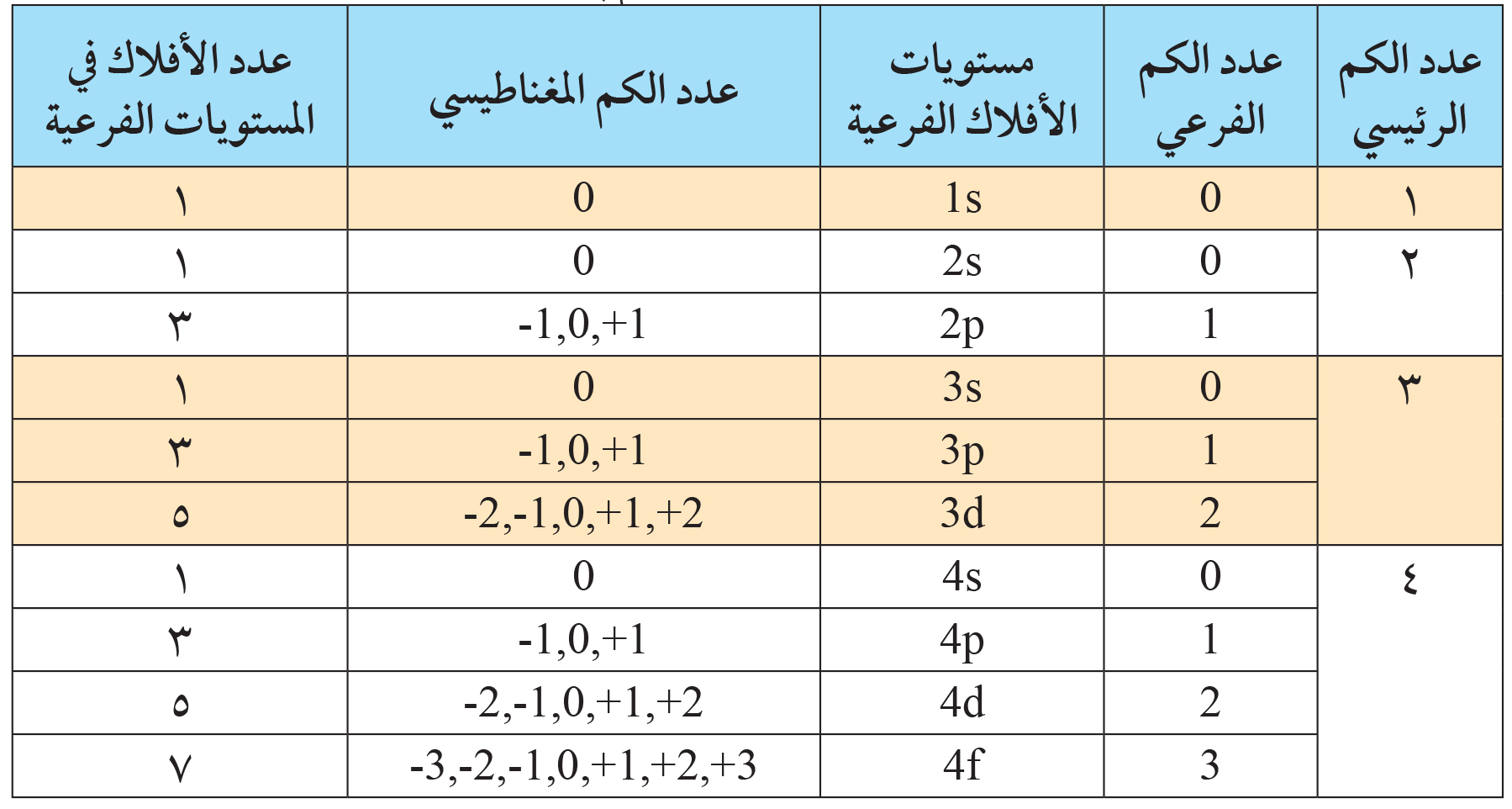
يمكن أن تحتوي كل ذرة على إلكترونات سالبة الشحنة أو بروتونات موجبة الشحنة، ويمتلك كل إلكترون في الذرة نوعًا من الطاقة يعتمد مبدأه على العلاقة بين الإلكترون سالب الشحنة والنواة موجبة الشحنة، من ناحية، ومن ناحية أخرى كف، حول علاقته بالإلكترونات سالبة الشحنة داخل نفس الذرة، ويمكن أن تختلف هذه الطاقة في الذرة عن طريق الزيادة أو النقصان اعتمادًا على عدد تلك الإلكترونات، وقد وجد الكيميائيون طريقة سهلة لحساب عدد تلك الإلكترونات في الذرة عن طريق تقسيم الذرة إلى عدة مستويات طاقة اعتمادًا على مسافة الإلكترون من مركز الذرة “النواة موجبة الشحنة”، لذلك فإن الاختلاف في عدد هذه الإلكترونات في كل مستوى سيؤدي إلى اختلاف في كمية الطاقة.
أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو
تنقسم مستويات الطاقة الرئيسية في الذرة إلى أرقام، من المستويات 1 إلى 7 لكل مستوى أقصى عدد من الإلكترونات التي يمكن استيعابها في مستوى الطاقة الرئيسي، لذلك فإن الإجابة الصحيحة على السؤال التالي هي
أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو 18.
يبدأ المستوى الأول دائمًا بإلكترونين، ويتم حساب الحد الأقصى بضرب رقم المستوى بنفسه في عدد الإلكترونات، وتضرب النتيجة مرة أخرى في عدد الإلكترونات في أدنى مستوى في المستوى الأول لذلك، لمعرفة عدد الإلكترونات في مستوى الطاقة الثالث، نقوم بضرب عدد المستوى، وهو ثلاثة، في حد ذاته، وفقًا لعدد الإلكترونات في أدنى مستوى في المستوى الأول، أي مرتين، ثم اضرب النتيجة في أقل عدد من الإلكترونات، وهو إلكترونان، مما يعني أن الحد الأقصى لعدد الإلكترونات في المستوى الثالث = 2 × (3²) = 3 × 3 × 2 = 18.
كم عدد الإلكترونات في مستويات الطاقة الرئيسية
يمكن حساب عدد الإلكترونات في مستويات الطاقة الرئيسية من البيانات التالية
- توجد الإلكترونات في الذرة في مدارات حول النواة تسمى مستويات الطاقة.
- قسّم العلماء هذه المستويات إلى سبعة مستويات رئيسية تتوافق مع المستويات الفرعية.
- الأقرب إلى النواة يسمى مستوى الطاقة الأول، ثم الثاني، ثم الثالث، ثم الرابع، وهكذا، بحيث يبتعد كل واحد عن المستوى الذي يسبقه ويتبعه قليلاً.
- كل مستوى يمتص الحد الأقصى من عدد الإلكترونات، وينتقل الفائض إلى المستوى التالي.
- عندما يحتوي مستوى الطاقة الأول على إلكترونين، تنتقل الإلكترونات التالية إلى مستوى الطاقة الثاني حتى يحتوي المستوى الثاني على 8 إلكترونات.
- تسمى الإلكترونات الموجودة في مستوى الطاقة الأبعد عن مركز الذرة إلكترونات التكافؤ.
- في الجدول الدوري، تحتوي جميع الذرات الموجودة في نفس العمود (المجموعة) على نفس عدد إلكترونات التكافؤ في المستوى الخارجي للإلكترون.