كميه المذاب التي تذوب في 100 جرام من المذيب تمثل التركيز
كميه المذاب التي تذوب في 100 جرام من المذيب تمثل التركيز، هل هذه العبارة صحيحة أم خاطئة لأن تركيز المحلول من أهم الأشياء في الكيمياء ، إلى جانب تعريف واستخدام المذيب.
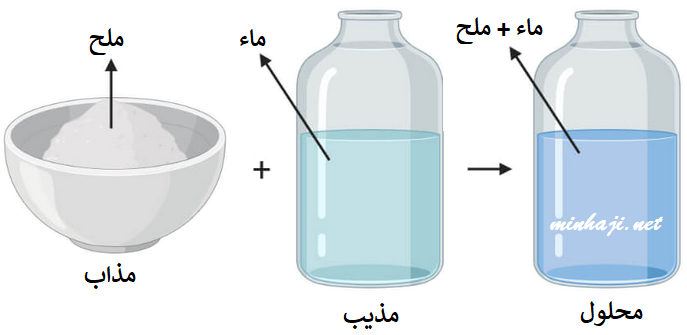
ما هو المذاب
ثم المذيب هو سائل أو غاز يستخدم لإذابة المواد الصلبة أو السوائل أو الغازات الأخرى ينتج عن عملية الذوبان هو الحل، يوجد عدد كبير من المذيبات في الكيمياء، وأشهرها الماء، لأن المذيبات تنقسم إلى نوعين أساسيين حسب قاعدة “Like” لا يُسمح إلا بأخرى مماثلة ” هؤلاء هم
- المذيبات العضوية تستخدم بعض هذه المذيبات في الحياة اليومية، مثل التولوين الذي يستخدم لتوسيع الدهان، أو في عوامل التنظيف، مثل الإيثر البترولي الهكسان.
- المذيبات غير العضوية تستخدم هذه المذيبات، باستثناء الماء، فقط في المعامل الكيميائية وعمليات التنقية.
كميه المذاب التي تذوب في 100 جرام من المذيب تمثل التركيز
ووردت هذه الجملة في أحد أسئلة الصواب والخطأ وكانت الإجابة الصحيحة عليها كالتالي
- كمية المذاب التي تذوب في 100 جرام من المذيب تمثل التركيز.
لأن التركيز يشير إلى كمية المادة المذابة في المحلول أو عدد جرامات المادة المذابة في لتر واحد من المحلول.
ما هو التركيز في الكيمياء
يشير مصطلح التركيز في الكيمياء إلى نسبة كمية مادة واحدة موجودة في مادة أخرى، ويمكن أن يشمل هذا المفهوم جميع أنواع المخاليط الكيميائية، ولكنه كثيرًا ما يستخدم في المحاليل المتجانسة، حيث يشير تركيز المحلول إلى نسبة مادة مذابة في المذيب، وبالتالي فإن عبارة “كمية المذاب التي تذوب في 100 جرام من المذيب، يكون التركيز غير صحيح.
كم أنواع التركيز في الكيمياء
ثم يمكن التعبير عن تركيز محلول كيميائي بعدة صيغ مختلفة، من أهمها ما يلي
- التركيز الوزني هو كتلة المادة المذابة مقسومة على حجم المحلول الكامل، أي أنه يشير إلى عدد الجرامات المذابة في لتر واحد من المحلول.
- والتركيز المولي يشير هذا المصطلح إلى عدد مولات مادة مذابة في محلول، حيث يمكن تعريف الكتلة المولية على أنها الوزن مقسومًا على عدد المولات، بينما يتم حساب التركيز المولي بقسمة الكتلة المولية على الحجم من الحل.